病理性近视
引言
病理性近视(pathologic myopia,PM)的并发症是最佳矫正视力(best-corrected visual acuity,BCVA)丧失的主要原因,尤其是在东亚[1-6]。 除了由于特定的并发症导致的裸眼视力下降外,BCVA的丧失也是PM的一个主要特征。PM的并发症主要发生在黄斑和视神经区域。包含后巩膜葡萄肿在内的眼球畸形可能会促进这些病理改变的发生发展。
PM的定义
对于“PM”的定义,研究中尚没有统一的标准,其他术语如“高度近视(high myopia,HM)”也同样地被使用。然而,“HM”本意是高度的近视,并不总是意味着存在导致BCVA下降的并发症。
在大多数早期的流行病学研究中,屈光不正[-5.0屈光度(diopters,D),-6.0 D,-8.0 D],眼轴(>26.0 mm,>26.5 mm),或两者联合来定义“PM”。然而,基于屈光不正或眼轴增加的定义被认为只能表明“高度近视(= HM)”。另外,为什么选择这些分界值并没有明确的科学根据。
眼轴的过度伸长和后巩膜葡萄肿被认为是PM后部眼底病变发展的重要因素[7-11]。然而,仅凭屈光不正或眼轴长度往往并不能充分地反映“PM”。作为PM的标志性病变,后巩膜葡萄肿也可发生在非高度近视眼中[12,13]。最近,一个国际近视研究小组回顾了以前发表的研究和分类方法,并提出了一个简化的、统一的PM分类系统,供将来的研究使用[14]。在这个META-PM(PM的Meta分析)研究分类中,PM被定义为存在等同于或比弥漫性萎缩更严重的脉络膜视网膜萎缩的眼睛或存在后巩膜葡萄肿的眼睛[15,16]。
PM的并发症
PM黄斑病变
Curtin和Karlin在1970年首次提出了近视性黄斑病变的定义,包括脉络膜视网膜萎缩、中央色素斑、漆裂纹、后巩膜葡萄肿和视盘改变等特征[12]。后来,Tokoro[17]将近视性黄斑病变的分类更新为四类:(I) 豹纹状眼底;(II) 弥漫性脉络膜视网膜萎缩;(III) 斑片状脉络膜视网膜萎缩;和(IV) 黄斑出血。随后,Avila等人[18]根据近视性视网膜病变的严重程度开发了一个分类法: 从M0:眼底后极部正常;M1:脉络膜苍白和豹纹状;M2:M1改变伴后巩膜葡萄肿;M3:M2改变伴漆裂纹;M4:M3改变伴局灶性深层脉络膜萎缩;到最严重的程度M5:M4改变伴大片区域的深层脉络膜萎缩和巩膜暴露。
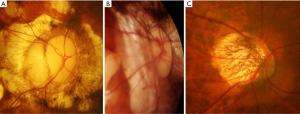
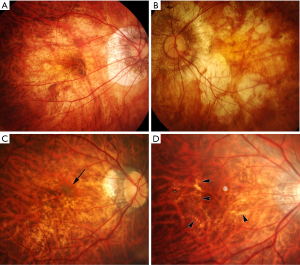
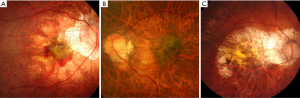
最近,一个国际近视研究小组回顾了以前发表的研究和分类方法,并提出了一个简化的、统一的PM分类系统,供将来的研究使用[14]。在这个简化的系统中(META-PM分类;表1),近视性黄斑病变被分为5类,从 “无近视性视网膜病变”(0类)、“仅豹纹状眼底”(1类)、“弥漫性脉络膜视网膜萎缩”(2类;图1A)、“片状脉络膜视网膜萎缩”(3类;图1B),到“黄斑萎缩”(4类)。在这些类别中又增加了三个附加特征,并用“附加病变”表示:(I)漆裂纹(图1C);(II)近视性CNV(图1D);以及(III)Fuchs斑。单独定义这些“附加病变”的原因是,这3种病变已被证明与中心视力下降密切相关,但它们并不归属于任何特定的类别,可能是由上述任何一种近视性黄斑病变的分类发展而来,或与之共存。根据这种新的分类方法,PM被定义为近视性黄斑病变的第2类或以上,或存在“附加”病变,或存在后巩膜葡萄肿[15,19]。

Full table
目前,基于我们最近的随访时间较长的研究(>10年),正在进行对META-PM分类的更新修改。较长时间的随访数据显示,从C3到C4的进展并不常见,且大多数C4与近视性CNV有关。此外,Fuchs斑是近视性CNV的色素性瘢痕。并非所有近视性CNV的瘢痕期都会表现色素沉着增加。因此,最好不要单独确定Fuchs斑,而是将活动期和瘢痕期一起归入近视性CNV的范畴。最后,从C2至C4的病变是PM特有的,而C1甚至在轻度近视中也可见到,C0只是正常眼底。因此,新的分类预计只包括PM特征性病变(即C2、C3、C4、漆裂纹、近视性CNV),最好称之为“PM黄斑病变”。基于随访时间更长的研究制定的最新分类预计将很快公布。
PM黄斑病变中各个病变的特征
弥漫性萎缩
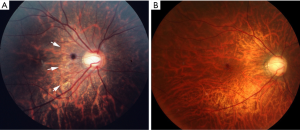
弥漫性脉络膜视网膜萎缩是在高度近视眼的后部眼底观察到的边界不清的淡黄色病变(图1)。该病变开始出现在视盘周围(视乳头周围弥漫性脉络膜视网膜萎缩;peripapillary diffuse chorioretinal atrophy,PDCA),并随着年龄的增长而扩大,最后覆盖整个后巩膜葡萄肿的区域(图2)。
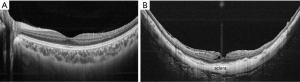
弥漫性萎缩的主要特征是脉络膜明显变薄(几乎没有)。光学相干断层扫描(optical coherence tomography,OCT)显示弥漫性萎缩区域的脉络膜明显变薄(图3)。在大多数病例中,除了零星存在的脉络膜大血管外,脉络膜几乎不存在。即使在大部分脉络膜消失的区域也存在外层视网膜和RPE,这可能是弥漫性萎缩的眼睛视力相对保留的原因。据Okisaka报道,PM的脉络膜改变始于毛细血管前小动脉或毛细血管后微静脉的闭塞,然后是脉络膜毛细血管层的闭塞。最后,脉络膜大血管层也闭塞,脉络膜似乎不存在了。在脉络膜血管发生改变的同时,脉络膜的黑色素细胞也消失了。虽然豹纹状眼底的眼睛脉络膜会变薄,但有弥漫性萎缩的眼睛中脉络膜变薄的程度更严重。与周围组织(RPE、外层视网膜和巩膜)相比,这种不相称的脉络膜变薄可能是弥漫性萎缩的一个关键现象。
最近,Yokoi等[20]报道,在一项自从童年开始超过20年的长期随访研究中,83%患有PM的成人在童年时期就已有PDCA。OCT显示PDCA是视乳头周围脉络膜的突然局灶性丢失[21]。
斑片状萎缩(图3;彩色,AF,OCT);黄斑Bruch’s膜(BM)缺损
斑片状脉络膜视网膜萎缩表现为灰白色、边界清楚的萎缩(图1)[17]。由于RPE和大部分脉络膜的缺失,被认为是白色的巩膜可通过透明的视网膜组织观察到。脉络膜大血管层和巩膜内血管似乎在斑片状萎缩区域内走行。在某些情况下,通过斑片状萎缩可以观察到球后血管,并随着视线移动而移动。荧光素血管造影(fluorescein angiogram,FA)和吲哚菁绿血管造影(indocyanine green angiogram,ICGA)显示斑片状萎缩区域的脉络膜充盈缺损,表明该病变是脉络膜毛细血管层的完全闭塞[17]。
利用最新的成像技术扫频源OCT,Ohno-Matsui等[22]最近报道了斑片状萎缩不仅仅是脉络膜视网膜萎缩,而是BM的裂孔(图4)。在没有BM的斑片状萎缩区域,脉络膜、RPE和外层视网膜的大部分厚度都已丢失,内层视网膜直接坐落于巩膜上。这与大多数弥漫性萎缩的眼睛中保留了RPE和外层视网膜的事实相反,尽管尚不确定这些眼睛中残余的光感受器和RPE是否正常工作。
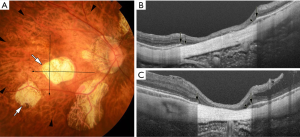
斑片状萎缩分为三种亚型:由漆裂纹发展的斑片状萎缩;P(Lc),晚期弥漫性脉络膜视网膜萎缩区域内发展的斑片状萎缩;P(D),以及沿后巩膜葡萄肿边缘可见的斑片状萎缩;P(St)[23]。P(Lc)被认为是Lc部位BM的破裂扩大。P(St)被认为是后巩膜葡萄肿边缘BM的机械性断裂。P(D)是指在极薄脉络膜区域新发展的BM裂孔。
Jonas等[24]最近报道,在组织学上眼轴长度≥26.5mm的高度近视眼中,有30.8%发现了黄斑BM缺损。BM缺损的缺乏可能与黄斑ICC的发展有关。由于薄巩膜上除了缺乏脉络膜外,还缺乏抗拉的BM,所以斑片状萎缩的区域在承受内部压力负荷时非常脆弱。巩膜可在斑片状萎缩的区域向后弯曲,类似于高度近视眼中近视圆锥附近形成的脉络膜内空洞(视乳头周围脉络膜内空洞;peripapillary intrachoroidal cavitations,视乳头周围ICC)。
Ito-Ohara等[25]检查了斑片状萎缩扩大的方向,发现后巩膜葡萄肿边缘病变的斑片状萎缩向黄斑扩大,而黄斑区的斑片状萎缩则向各个方向扩大[25]。然而,中心凹外的斑片状萎缩后来累及中心凹并不常见。这意味着,尽管萎缩区域内的光感受器丢失导致旁中心绝对暗点,但斑片状萎缩导致中心视力丧失是罕见的。
漆裂纹
漆裂纹是细小的、不规则的黄线,常分支和交叉,见于高度近视眼的后部眼底(图1)。Curtin和Karlin[12]报道, 4.3%的高度近视眼中发现了漆裂纹。在组织学上,漆裂纹代表RPE-BM-脉络膜毛细血管复合体中已愈合的机械裂纹[26]。
在高度近视患者中,漆裂纹可在相对较早的年龄就形成(例如30岁)。漆裂纹发生率最高的年龄组为20至39岁。Klein和Curtin[27]报道,漆裂纹患者的平均年龄为32岁,范围为14至52岁。Tokoro[17]报道,20岁以下的患者和老年人出现漆裂纹的频率较低,但在40到60岁左右增加。漆裂纹的频率分布在35-39岁之间和55-59岁之间呈现出两个高峰。
在近视性黄斑病变的各种病变中,漆裂纹可能是一种独特的病变,因为它们几乎完全是由眼球的机械扩张引起的,并且不受老化的影响。事实证明了这一点,实验性近视的小鸡模型在视觉剥夺2周内可发展为轴性近视,形成漆裂纹[28]。实际上,漆裂纹和由新漆裂纹形成引起的视网膜下出血是据报道在实验性近视动物模型中出现的唯一的黄斑病变。这也支持了LASIK手术[29-33]或激光光凝术[34]后漆裂纹的形成。
在OCT检查中,漆裂纹是由于光穿透深度组织增加,RPE不连续而观察到的。最新的技术OCT血管造影术可以清楚地显示脉络膜毛细血管的破裂。
中心凹出现漆裂纹的情况并不常见。因此,漆裂纹本身通常不会损害中心视力,然而,在BM破裂时出现的视网膜下出血会导致中心视力的损害,即使在出血被吸收后也是如此。
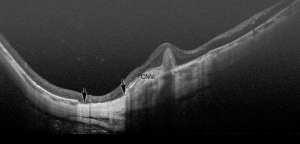
近视性CNV和CNV相关性黄斑萎缩(图5, 图6)
近视性CNV是PM威胁视力的主要并发症。它是50岁以下人群CNV最常见的原因,也是整个CNV的第二大原因[35,36]。近视性CNV往往较小,因此约有20%的CNV位于中心凹外[37]。其中大多数是II型CNV,位于RPE上。近视性CNV在自然病程以及治疗后会经历三个阶段;活动期、瘢痕期和萎缩期(也称近视性CNV相关性黄斑萎缩)(图7)。
自从10年前眼科引入抗VEGF药物以来,玻璃体腔内抗VEGF疗法的抗血管生成治疗已成为近视性CNV的标准一线治疗方法[15,38]。此外,进行了两项大型的多中心、双盲、随机、对照的临床试验,以评估抗VEGF治疗对近视性CNV的应用[39,40],即RADIANCE研究(玻璃体腔内注射雷珠单抗)和MYRROR研究(玻璃体腔内注射阿柏西普)。这两项大型临床试验的结果非常有前景,显著改善了近视性CNV患者的视觉效果。
然而,抗VEGF治疗对发生在瘢痕性近视性CNV即CNV相关性黄斑萎缩周围的晚期并发症是否有效尚未完全阐明。最近Ohno-Matsui等[41]使用扫频源OCT进行的研究表明,CNV相关性黄斑萎缩也是CNV周围BM的扩大的裂孔(图5)。为了提高抗VEGF治疗近视性CNV的长期效果,预防CNV周围BM裂孔的扩大是十分有必要的。
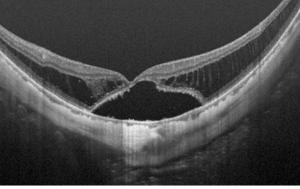
近视性牵引性黄斑病变 (myopic traction maculopathy,MTM)(图6)
Takano和Kishi首次利用OCT证明了患有后巩膜葡萄肿的严重近视眼有中心凹视网膜脱离和视网膜劈裂[42]。Panozzo和Mercanti[43]提出了“近视性牵引性黄斑病变(MTM)”一词,涵盖了高度近视眼中OCT常见的各种牵引表现。OCT是诊断MTM不可或缺的工具,它允许在体内检查黄斑形态,如裂隙状视网膜内液、裂隙状视网膜外液、中心凹脱离、板层或全层黄斑裂孔和/或黄斑脱离。
对于MTM的发展,已经提出了几种机制,包括部分玻璃体后脱离[42,43]、视网膜前膜、自身内界膜不连续[44]和视网膜小动脉硬化等导致的玻璃体黄斑牵引[45]。
Shimada等[46]根据MTM的位置和程度对其进行了分类,从S0到S4。S0:无视网膜劈裂;S1:中心凹外;S2:中心凹;S3:中心凹和中心凹外但未累及整个黄斑;S4:整个黄斑。
由于可能的机制参与了MTM的发病机制,玻璃体切除术是解除所有视网膜牵引的最常见治疗方法,包括玻璃体皮质和视网膜前膜。采用保留中心小凹ILM(inner limiting membrane,内界膜)的特殊手术技术来减少玻璃体切除术后黄斑裂孔的形成,这是一个严重的并发症,可导致视力恢复不良[47,48]。
PM 的青光眼和视野 (visual field,VF) 缺损
早期的研究结果表明,高度近视眼青光眼的高患病率是一个非常令人关注的问题,因为高度近视眼的青光眼诊断很困难,因此往往被忽视。在PM患者眼中,VF的结果很难解释。PM眼通常有一个大圆锥并伴有不同程度的黄斑病变,这使得自动VF检查的分析和解释变得困难。因此,大多数检查青光眼患病率的研究都排除了高度近视眼。高度近视眼的视乳头和视乳头周围区域因眼球的机械拉伸而变形。拉伸导致了各种类型的视盘畸形形成(图8),包括倾斜视盘[49],后天的大视盘[50-52],和小视盘。Nagaoka等[50]研究表明,合并大视盘的HM眼患青光眼性视神经病变的风险要比正常视盘或较小视盘的HM眼高3.2倍。
除了视盘本身的机械性畸形外,据报道还有其他因素与PM眼的VF缺损有关。通过使用扫频源OCT,Ohno-Matsui等[53]报道患有PM的眼睛中视神经蛛网膜下腔(subarachnoid space,SAS)似乎扩张了。暴露于脑脊液压力下的扩张区域以及眼球后壁的变薄可能影响巩膜葡萄肿的形成以及某些疾病(如青光眼)的表现方式。在某些情况下,他们还报道了眼内腔和SAS空间之间的直接联系[53]。
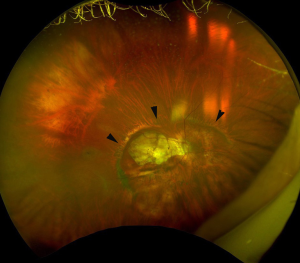
在16%的PM眼中观察到视盘外缘或相邻巩膜新月体内有凹坑状裂隙,但在正视眼中则没有[54]。在凹陷部位,覆盖在凹坑上的神经纤维组织是不连续的,这可能解释了在某些情况下高度近视眼VF缺损的原因。此外,在PM眼中也观察到视乳头周围脉络膜内空洞(ICC)上的神经纤维组织丢失[55],它被认为是导致VF缺损的原因之一[56]。
后巩膜葡萄肿(图9)
后巩膜葡萄肿是眼后段局限性区域的向外突出[9],它是PM眼的典型畸形。后巩膜葡萄肿不是PM黄斑病变的损害,而是黄斑和视神经出现并发症的原因所在。较早期的研究表明,后巩膜葡萄肿的存在与视力较差、近视性黄斑并发症的更频繁形成以及视神经损伤显著相关。巩膜可保护中枢神经组织,例如神经视网膜和视神经免受机械性损伤。因此,后巩膜葡萄肿引起的眼睛畸形可能导致视网膜和视神经的机械性损伤是合理的。
根据检眼镜观察和眼底素描,Curtin[7]首次将PM眼的后巩膜葡萄肿分为10种不同的类型。I至V型为原发性后巩膜葡萄肿,VI至X型为联合性后巩膜葡萄肿。最近,新的成像模式可以获得整个眼球的图像,如3D MRI[10,57,58]或超广角眼底成像(如欧堡)已成为可能。Ohno-Matsui[58](图10)结合3D MRI和欧堡检查了后巩膜葡萄肿的患病率和类型。眼部影像学的这些进展使得对后巩膜葡萄肿的客观和定量评估成为可能。
因此,以巩膜为靶点的治疗被认为对预防后巩膜葡萄肿的发生和发展具有潜在的作用。针对HM的后巩膜加固手术主要在俄罗斯和中国进行,美国和澳大利亚的一些团体也提倡对PM进行巩膜加固。胶原交联最近被引入用于治疗进行性圆锥角膜和屈光手术后角膜扩张症。Wollensak等[59]率先使用核黄素和紫外线(ultraviolet light,UVA)交联胶原并增强角膜的机械性能。巩膜胶原交联治疗近视的效果已被检验[60],并有望成为未来预防PM后巩膜葡萄肿的治疗方法。最近,Shinohara等[61]报道,巩膜上的成纤维细胞移植将导致巩膜上胶原纤维的合成及增强,并降低形觉剥夺性近视眼的眼轴伸长程度。因此,利用患者自身的成纤维细胞进行再生治疗可能是预防PM严重并发症的原因——后巩膜葡萄肿的一种有前景的方法。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Ian G. Morgan, Xiaohu Ding and Xinxing Guo) for the series “Managing Myopia in East Asia Myopia Crisis” published in Annals of Eye Science. The article has undergone external peer review.
Conflicts of Interest: The author has completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/aes.2018.01.03). The series “Managing Myopia in East Asia Myopia Crisis” was commissioned by the editorial office without any funding or sponsorship. The author has no other conflicts of interest to declare.
Ethical Statement: The author is accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Asakuma T, Yasuda M, Ninomiya T, et al. Prevalence and risk factors for myopic retinopathy in a Japanese population: The Hisayama Study. Ophthalmology 2012;119:1760-5. [Crossref] [PubMed]
- Xu L, Wang Y, Li Y, et al. Causes of blindness and visual impairment in urban and rural areas in Beijing: the Beijing Eye Study. Ophthalmology 2006;113:1134.e1-11. [Crossref] [PubMed]
- Liang YB, Friedman DS, Wong TY, et al. Prevalence and causes of low vision and blindness in a rural chinese adult population: the Handan Eye Study. Ophthalmology 2008;115:1965-72. [Crossref] [PubMed]
- Chang L, Pan CW, Ohno-Matsui K, et al. Myopia-related fundus changes in singapore adults with high myopia. Am J Ophthalmol 2013;155:991-9.e1. [Crossref] [PubMed]
- Morgan IG, Ohno-Matsui K, Saw SM. Myopia. Lancet 2012;379:1739-48. [Crossref] [PubMed]
- Wong YL, Saw SM. Epidemiology of pathologic myopia in Asia and worldwide. Asia Pac J Ophthalmol (Phila) 2016;5:394-402. [Crossref] [PubMed]
- Curtin BJ. The posterior staphyloma of pathologic myopia. Trans Am Ophthalmol Soc 1977;75:67-86. [PubMed]
- Steidl SM, Pruett RC. Macular complications associated with posterior staphyloma. Am J Ophthalmol 1997;123:181-7. [Crossref] [PubMed]
- Spaide RF. Staphyloma: Part 1. Pathologic Myopia. New York: Springer, 2014.
- Moriyama M, Ohno-Matsui K, Hayashi K, et al. Topographical analyses of shape of eyes with pathologic myopia by high-resolution three dimensional magnetic resonance imaging. Ophthalmology 2011;118:1626-37. [Crossref] [PubMed]
- Ohno-Matsui K, Akiba M, Modegi T, et al. Association between shape of sclera and myopic retinochoroidal lesions in patients with pathologic myopia. Invest Ophthalmol Vis Sci 2012;53:6046-61. [Crossref] [PubMed]
- Curtin BJ, Karlin DB. Axial length measurements and fundus changes of the myopic eye. I. The posterior fundus. Trans Am Ophthalmol Soc 1970;68:312-34. [PubMed]
- Wang NK, Wu YM, Wang JP, et al. Clinical characteristics of posterior staphylomas in myopic eyes with axial length shorter than 26.5 mm. Am J Ophthalmol 2016;162:180-90.e1. [Crossref] [PubMed]
- Ohno-Matsui K, Kawasaki R, Jonas JB, et al. International photographic classification and grading system for myopic maculopathy. Am J Ophthalmol 2015;159:877-83.e7. [Crossref] [PubMed]
- Ohno-Matsui K, Lai TY, Lai CC, et al. Updates of pathologic myopia. Prog Retin Eye Res 2016;52:156-87. [Crossref] [PubMed]
- Ohno-Matsui K. What is the fundamental nature of pathologic myopia? Retina 2017;37:1043-8. [Crossref]
- Tokoro T. editor. Atlas of Posterior Fundus Changes in Pathologic Myopia. Types of fundus changes in the posterior pole. Tokyo: Springer-Verlag, 1998.
- Avila MP, Weiter JJ, Jalkh AE, et al. Natural history of choroidal neovascularization in degenerative myopia. Ophthalmology 1984;91:1573-81. [Crossref] [PubMed]
- Verkicharla PK, Ohno-Matsui K, Saw SM. Current and predicted demographics of high myopia and an update of its associated pathological changes. Ophthalmic Physiol Opt 2015;35:465-75. [Crossref] [PubMed]
- Yokoi T, Jonas JB, Shimada N, et al. Peripapillary diffuse chorioretinal atrophy in children as a sign of eventual pathologic myopia in adults. Ophthalmology 2016;123:1783-7. [Crossref] [PubMed]
- Yokoi T, Zhu D, Bi HS, et al. Parapapillary diffuse choroidal atrophy in children is associated with extreme thinning of parapapillary choroid. Invest Ophthalmol Vis Sci 2017;58:901-6. [Crossref] [PubMed]
- Ohno-Matsui K, Jonas JB, Spaide RF. Macular Bruch membrane holes in highly myopic patchy chorioretinal atrophy. Am J Ophthalmol 2016;166:22-8. [Crossref] [PubMed]
- Hayashi K, Ohno-Matsui K, Shimada N, et al. Long-term pattern of progression of myopic maculopathy: a natural history study. Ophthalmology 2010;117:1595-611. [Crossref] [PubMed]
- Jonas JB, Ohno-Matsui K, Spaide RF, et al. Macular Bruch's membrane defects and axial length: association with gamma zone and delta zone in peripapillary region. Invest Ophthalmol Vis Sci 2013;54:1295-302. [Crossref] [PubMed]
- Ito-Ohara M, Seko Y, Morita H, et al. Clinical course of newly developed or progressive patchy chorioretinal atrophy in pathological myopia. Ophthalmologica 1998;212:23-9. [Crossref] [PubMed]
- Grossniklaus HE, Green WR. Pathologic findings in pathologic myopia. Retina 1992;12:127-33. [Crossref] [PubMed]
- Klein RM, Curtin BJ. Lacquer crack lesions in pathologic myopia. Am J Ophthalmol 1975;79:386-92. [Crossref] [PubMed]
- Hirata A, Negi A. Lacquer crack lesions in experimental chick myopia. Graefes Arch Clin Exp Ophthalmol 1998;236:138-45. [Crossref] [PubMed]
- Ellies P, Pietrini D, Lumbroso L, et al. Macular hemorrhage after laser in situ keratomileusis for high myopia. J Cataract Refract Surg 2000;26:922-4. [Crossref] [PubMed]
- Loewenstein A, Lipshitz I, Varssano D, et al. Macular hemorrhage after excimer laser photorefractive keratectomy. J Cataract Refract Surg 1997;23:808-10. [Crossref] [PubMed]
- Luna JD, Reviglio VE, Juarez CP. Bilateral macular hemorrhage after laser in situ keratomileusis. Graefes Arch Clin Exp Ophthalmol 1999;237:611-3. [Crossref] [PubMed]
- Principe AH, Lin DY, Small KW, et al. Macular hemorrhage after laser in situ keratomileusis (LASIK) with femtosecond laser flap creation. Am J Ophthalmol 2004;138:657-9. [Crossref] [PubMed]
- Loewenstein A, Goldstein M, Lazar M. Retinal pathology occurring after excimer laser surgery or phakic intraocular lens implantation: evaluation of possible relationship. Surv Ophthalmol 2002;47:125-35. [Crossref] [PubMed]
- Johnson DA, Yannuzzi LA, Shakin JL, et al. Lacquer cracks following laser treatment of choroidal neovascularization in pathologic myopia. Retina 1998;18:118-24. [Crossref] [PubMed]
- Cohen SY, Laroche A, Leguen Y, et al. Etiology of choroidal neovascularization in young patients. Ophthalmology 1996;103:1241-4. [Crossref] [PubMed]
- Neelam K, Cheung CM, Ohno-Matsui K, et al. Choroidal neovascularization in pathological myopia. Prog Retin Eye Res 2012;31:495-525. [Crossref] [PubMed]
- Yoshida T, Ohno-Matsui K, Yasuzumi K, et al. Myopic choroidal neovascularization: a 10-year follow-up. Ophthalmology 2003;110:1297-305. [Crossref] [PubMed]
- Lai TY, Cheung CM. Myopic choroidal neovascularization: diagnosis and treatment. Retina 2016;36:1614-21. [Crossref] [PubMed]
- Wolf S, Balciuniene VJ, Laganovska G, et al. RADIANCE: a randomized controlled study of ranibizumab in patients with choroidal neovascularization secondary to pathologic myopia. Ophthalmology 2014;121:682-92.e2. [Crossref] [PubMed]
- Ikuno Y, Ohno-Matsui K, Wong TY, et al. Intravitreal aflibercept injection in patients with myopic choroidal neovascularization: The MYRROR Study. Ophthalmology 2015;122:1220-7. [Crossref] [PubMed]
- Ohno-Matsui K, Jonas JB, Spaide RF. Macular Bruch's membrane holes in choroidal neovascularization-related myopic macular atrophy by swept-source optical coherence tomography. Am J Ophthalmol 2016;162:133-9.e1. [Crossref] [PubMed]
- Takano M, Kishi S. Foveal retinoschisis and retinal detachment in severely myopic eyes with posterior staphyloma. Am J Ophthalmol 1999;128:472-6. [Crossref] [PubMed]
- Panozzo G, Mercanti A. Optical coherence tomography findings in myopic traction maculopathy. Arch Ophthalmol 2004;122:1455-60. [Crossref] [PubMed]
- Kobayashi H, Kishi S. Vitreous surgery for highly myopic eyes with foveal detachment and retinoschisis. Ophthalmology 2003;110:1702-7. [Crossref] [PubMed]
- Ikuno Y, Gomi F, Tano Y. Potent retinal arteriolar traction as a possible cause of myopic foveoschisis. Am J Ophthalmol 2005;139:462-7. [Crossref] [PubMed]
- Shimada N, Tanaka Y, Tokoro T, et al. Natural course of myopic traction maculopathy and factors associated with progression or resolution. Am J Ophthalmol 2013;156:948-57.e1. [Crossref] [PubMed]
- Ho TC, Chen MS, Huang JS, et al. Foveola nonpeeling technique in internal limiting membrane peeling of myopic foveoschisis surgery. Retina 2012;32:631-4. [PubMed]
- Shimada N, Sugamoto Y, Ogawa M, et al. Fovea-sparing internal limiting membrane peeling for myopic traction maculopathy. Am J Ophthalmol 2012;154:693-701 [PubMed]
- You QS, Xu L, Jonas JB. Tilted optic discs: The Beijing Eye Study. Eye 2008;22:728-9. [Crossref] [PubMed]
- Nagaoka N, Jonas JB, Morohoshi K, et al. Glaucomatous-type optic discs in high myopia. PLoS One 2015;10:e0138825 [Crossref] [PubMed]
- Jonas JB, Gusek GC, Naumann GO. Optic disk morphometry in high myopia. Graefes Arch Clin Exp Ophthalmol 1988;226:587-90. [Crossref] [PubMed]
- Wang Y, Xu L, Zhang L, et al. Optic disc size in a population based study in northern China: the Beijing Eye Study. Br J Ophthalmol 2006;90:353-6. [Crossref] [PubMed]
- Ohno-Matsui K, Akiba M, Moriyama M, et al. Imaging the retrobulbar subarachnoid space around the optic nerve by swept source optical coherence tomography in eyes with pathologic myopia. Invest Ophthalmol Vis Sci 2011;52:9644-50. [Crossref] [PubMed]
- Ohno-Matsui K, Akiba M, Moriyama M, et al. Acquired optic nerve and peripapillary pits in pathologic myopia. Ophthalmology 2012;119:1685-92. [Crossref] [PubMed]
- Spaide RF, Akiba M, Ohno-Matsui K. Evaluation of peripapillary intrachoroidal cavitation with swept source and enhanced depth imaging optical coherence tomography. RETINA 2012;32:1037-44. [Crossref] [PubMed]
- Shimada N, Ohno-Matsui K, Yoshida T, et al. Characteristics of peripapillary detachment in pathologic myopia. Arch Ophthalmol 2006;124:46-52. [Crossref] [PubMed]
- Moriyama M, Ohno-Matsui K, Modegi T, et al. Quantitative analyses of high-resolution 3D MR images of highly myopic eyes to determine their shapes. Invest Ophthalmol Vis Sci 2012;53:4510-8. [Crossref] [PubMed]
- Ohno-Matsui K. Proposed classification of posterior staphylomas based on analyses of eye shape by three-dimensional magnetic resonance imaging and wide-field fundus imaging. Ophthalmology 2014;121:1798-809. [Crossref] [PubMed]
- Wollensak G, Spoerl E, Seiler T. Riboflavin/ultraviolet-a-induced collagen crosslinking for the treatment of keratoconus. Am J Ophthalmol 2003;135:620-7. [Crossref] [PubMed]
- Zyablitskaya M, Takaoka A, Munteanu EL, et al. Evaluation of therapeutic tissue crosslinking (TXL) for myopia using second harmonic generation signal microscopy in rabbit sclera. Invest Ophthalmol Vis Sci 2017;58:21-9. [Crossref] [PubMed]
- Shinohara K, Yoshida T, Liu H, et al. Establishment of novel therapy to reduce progression of myopia in rats with experimental myopia by fibroblast transplantation on sclera. J Tissue Eng Regen Med 2017; [Epub ahead of print]. [PubMed]
陈熹
中山大学中山眼科中心。眼科学博士,国际泪液与眼表协会会员、国际视觉发育视光师协会会员、百度认证深度学习工程师。担任《中华生物医学工程杂志》、《广州医科大学学报》等杂志青年编委,担任Neural Regen Res、《广东医学》等13个期刊审稿人。国内外会议发言近20次,以第一及共一作者在Cell Death Dis、Invest Ophthalmol Vis Sci等杂志上发表论文5篇。软件著作权4项,在申专利4项。(更新时间:2021/8/17)

宋新志
甘肃省人民医院。眼科医学硕士,毕业于郑州大学,甘肃省人民医院眼科医生。主要从事白内障、青光眼及眼底病(眼底外科方向)的临床研究,近五年以第一作者发表中文核心期刊论文1篇,目前2篇SCI论文正在外审中。(更新时间:2021/8/12)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Ohno-Matsui K. Pathologic myopia. Ann Eye Sci 2018;3:8.