小儿神经眼科学:不仅仅是小大人的神经眼科
引言
小儿神经眼科学是不同于成人神经眼科学的亚专业,尽管二者有许多相同的诊断信息,但小儿神经眼科在检查方法、临床表现和管理选择方面均有其独特性。此外,小儿神经眼科疾病的发病率较成人低,了解也相对较少。因此,“儿童不仅仅是小大人”是小儿神经眼科医生经常说的一句话。
本文的目的是通过描述常见临床表现、推荐管理策略、强调最新发展,来重点突出四种常见的小儿神经眼科疾病。最近,人们对小儿神经眼科疾病管理的兴趣激增,因此关于此方面的知识迅速增长。这篇综述将强调管理这些患者所需的临床标准,以及最新的研究进展。
儿童特发性颅内压增高
流行病学
据估计,在儿童和成人组成的人群中,IIH*的年发病率约为0.90/100000[1-3]。然而,儿童IIH的统计数据与成人不同。在成年IIH患者中,女性和肥胖占优势,而在青春前期的儿童患者中,男女分布相等,且肥胖相关性似乎不大[4-6]。青春后期儿童患者的人口学特征与成人患者更为相似,女性和肥胖与IIH相关性更强[7]。最近,Sheldon和同事[8]在一个多中心的国际队列中对儿童IIH患者进行了人体测量学评估。他们的研究结果显示,较年幼的IIH患者(女性7岁以下,男性8.5岁以下)的身高和体重正常;青春期患者存在较高、超重现象;而青春后期患者身高正常、肥胖却更明显。考虑到药物接触或其他系统性因素,继发性IIH的儿童患者尚未得到较好评估。
病理生理学
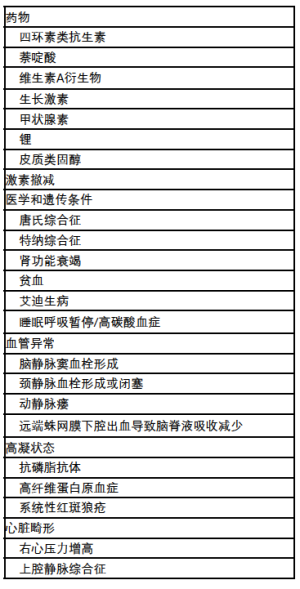
一般来说,IIH的病理生理学与脑脊液(cerebrospinal fluid,CSF)动力学异常有关:CSF流出受阻、分泌过多,或者两者兼而有之。虽然肥胖可能是成人和青春后期儿童IIH的诱因,但它却不是幼儿IIH的诱因,这两个年龄段的病理生理学仍在研究中。一种假说认为包括醛固酮在内的盐皮质激素途径可能参与其中,该假说可以解释为什么维生素A升高、肥胖和生长激素与儿童IIH有关[9]。而另一种学说认为,糖皮质激素代谢的改变也可能是病因[10]。最近的研究表明,青春前期IIH患者的CSF蛋白浓度往往较低,这表明CSF生成增加可能在这些儿童中发挥作用[11]。继发性颅内压增高可由多种可识别的原因引起,包括药物、疾病、大脑结构异常和停药(表1)。
Full table
临床表现和疾病管理
儿童IIH患者的临床症状可能与成人相似,如出现头痛、恶心、呕吐、复视、短暂性视物模糊和搏动性耳鸣。然而,与成人患者不同的是,儿童患者通常也会出现一些不明确的症状,如易怒、行为改变,30%的病例也可能没有任何症状[7]。儿童患者在常规检查中可能发现视乳头水肿或眼球运动障碍,从而被转诊进行评估。
儿童患者的神经眼科检查经常显示眼球运动异常,如10%~40%的患者出现外展神经麻痹,而共同性内斜视、动眼神经和滑车神经麻痹却比较少见[5,7]。到目前为止,这些患者最常见的临床表现是视乳头水肿,在大多数病例中均可观察到。IIH的诊断标准于2013年[12]进行了更新,纳入了颅内压升高的影像学特征以及儿童正常CSF压力的最新数据。这些标准包括[12]:
- 确诊IIH(同时满足1–5条)
- 视乳头水肿;
- 脑实质组织的MRI或CT正常;
- 静脉系统在MRV或CTV上正常;
- CSF组成正常;
- 腰椎穿刺显示颅内压升高(儿童患者大于28 cmH2O,如果未用镇静剂或存在肥胖,则大于25cmH2O);
- 很可能为IIH
- 疑似IIH
此外,针对缺乏乳头状水肿但有外展神经麻痹患者,如同时存在上述2–5条,也可诊断为IIH。
除腰椎穿刺显示颅内压正常外,所有特征均符合确诊IIH的1–4条。
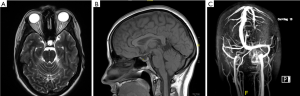
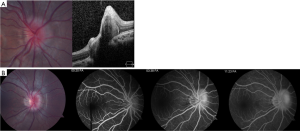
缺乏视乳头水肿和外展神经麻痹,但存在上述2–5条和神经影像学表现(图1),如视神经周围蛛网膜下腔扩张伴或不伴视神经迂曲、眼球后部扁平、空蝶鞍和横静脉窦狭窄。
根据上述诊断标准,建议对疑似IIH患儿行MRI结合MRV检查。最近的几项研究深入探讨了儿童IIH的MRI表现[13-16]。这些研究表明,MRI最常见的表现是视神经鞘增大(64%)和弯曲(30%~90%),其次是视神经在眼内的突出(17%~27%)、空蝶鞍(26%)和眼球后扁平(45%~60%)[13,17]。在进行MRI/MRV检查后,需要进行腰椎穿刺,以确定颅内压和CSF是否正常。此外,最近的研究也表明了其他辅助检查的作用,如视神经和黄斑的光学相干断层扫描(OCT)。如果一些患者对治疗的反应尚不明确,则建议使用OCT。例如,一项研究发现,视神经和光感受器萎缩与视力丧失和IIH进展高度相关[18]。一项类似的研究表明,OCT可以观察到视网膜神经纤维层(rNFL)和黄斑厚度的增加,并将其用作评估和监测IIH的工具[19]。尽管如此,用于监测疾病进展的OCT最佳参数仍有争议,包括Bruch膜向内倾斜的程度[20,21]、黄斑神经节细胞层、内丛状层[20]、视神经体积[22]或rNFL。
一旦诊断IIH,将根据每个患者表现的严重程度进行治疗。治疗目标包括缓解头痛、复视、提高视力,以及预防视乳头水肿造成的永久性视力丧失。通常,视力和视野正常的无症状患者可以通过观察或给予小剂量乙酰唑胺进行保守治疗。此外,对于继发性IIH必须治疗诱因。在出现不良症状或轻度视力损害的情况下,乙酰唑胺是一线药物,通常15–25 mg/kg/天,分两或三次进行治疗,必要时可增加至100 mg/kg/天(每天最多2克)。如果患者对乙酰唑胺副作用不耐受,则可考虑使用托吡酯和速尿等替代药物。一旦视乳头水肿消退,视野恢复正常,药物可以逐渐减量。经常监测视力、视野和视神经结构对避免疾病恶化至关重要。在暴发性或严重的急性病例中,偶尔需要手术治疗。对于一些病人,为尽量减轻视力严重下降,静脉注射类固醇可作为一种临时措施。根据患者症状以及治疗机构的不同,手术治疗可能包括视神经鞘开窗或CSF分流。在所有情况下,均应注意患者的体重指数,并鼓励肥胖或超重患者减肥。
未来发展方向
IIH治疗试验(Idiopathic Intracranial Hypertension Treatment Trial)是第一个治疗成人IIH的随机对照试验[23]。虽然没有儿童参与本研究,但从中收集到的数据可能对儿科患者有重要意义。例如,这项研究确定视力越差、视乳头水肿越明显,则预后越差——儿童也可能存在同样结果,因此可能鼓励临床医生在发病初期更积极地进行治疗。此外,在IIH的管理阶段,有更多的研究使用各种OCT来诊断、监测IIH,从而可能避免腰椎穿刺等侵入性检查。最后,还必须阐明IIH的病理生理学,以便制定相关的治疗方法,特别是对那些表现最严重的患者。
儿童假性视乳头水肿和视盘玻璃膜疣(ODD)
流行病学
儿童假性视乳头水肿是视乳头水肿的常见鉴别诊断。假性视乳头水肿的一个常见原因是ODD,后者是视乳头上的先天性良性沉积物。ODD常常包埋在视神经头内,因此在儿科患者中不易看见。高达76%的假性视乳头水肿患者[24]可能被误诊为真性视乳头水肿,导致了不必要的、昂贵的侵入性检查。因此,眼科医生鉴别真性和假性视乳头水肿至关重要。儿童ODD的患病率约为0.4%;而成年人的患病率则更高,范围在0.5%~2.4%之间,可能是因为ODD在成年人中更容易被发现[25-27]。ODD的患病率也因种族而异,其中白种人患病率较高[28]。ODD通常发生在有ODD家族史的儿童中,并可能作为遗传综合征的一部分,如视网膜色素变性、弹性假黄瘤[29,30]和Alagille综合征[31]。
与成人相比,儿童患者的ODD似乎不同。儿童的ODD经常被包埋在视神经内(图2),而成年人的ODD常位于视盘表面,并常常被钙化。由于这些差异,儿童的ODD不易观察和诊断。
病理生理学
ODD形成的确切原因尚不清楚,但有几种理论可以解释它们的存在。目前有两种最普遍接受的ODD形成理论:(I)轴浆流动缓慢导致轴突代谢紊乱[32,33](II)先天性小的或发育不良的视盘有改变轴浆流动的倾向,随后可能形成玻璃膜疣[34,35]。众多假说的统一特征是,ODD患者在解剖学上易存在小的巩膜管(或在正常巩膜管的情况下存在轴浆流动紊乱)[25]。
临床表现和疾病管理
由于大多数病例无症状,所以往往在常规眼科检查中偶然发现儿童ODD。先前的系列研究显示,大约一半的被评估为ODD的儿童可出现颅内压增高的症状,如头痛、恶心或呕吐,另一半的患者因为不相关的症状而进行眼科检查时发现[36]。较少的儿童会由于ODD出现症状,包括短暂的视觉模糊或视野缺损[37-39]。由于视野缺损更常见于表面玻璃膜疣,因此随着患者年龄的增长,视野缺损的发生率越来越高[40,41]。年幼(<10岁)ODD患者视野缺损的发生率估计为11%,而年长儿童为51%[28]。这些病例中最常见的视野缺损是鼻侧阶梯、弓型视野、生理盲点扩大和视野普遍性收缩[38]。除了视野缺损外,ODD患儿可能出现的体征还包括视网膜血管异常、视盘出血、相对性传入性瞳孔障碍(RAPD)和罕见的脉络膜新生血管膜。
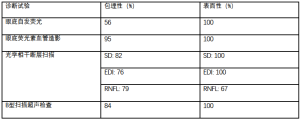
治疗假性视乳头状水肿的关键在于将其与真性视乳头水肿区分开来。因此,有许多研究通过评估各种检测手段,试图确定最准确的方法来进行鉴别,以避免昂贵或侵入性的测试,如MRI或腰椎穿刺。鉴别儿童真性和假性视乳头水肿的辅助测试,在准确度上各不相同(表2)。
B型扫描超声检查
超声B型扫描(B超)是一种廉价的无创检测,对诊断成人ODD非常有用[43,44]。诊断基于视神经实质内高回声肿块伴后方伪影。然而,这一特征只有在ODD钙化时才能看到,因此在成人中的敏感度约为48%[43]。由于儿童玻璃膜疣缺乏钙化,因此该检测在儿童中的敏感度可能更低。然而,在最近的一项儿科研究中,B超在区分真性和假性视乳头水肿方面有74%的准确率[42]。
眼底自发荧光
对比注射造影剂前成像和扫描激光检眼镜,自发荧光发现ODD更具优势[28]。与B超类似,自发荧光在检测表面性、钙化ODD方面具有更好的效用,而包埋性ODD的自发荧光被覆盖其上的视神经组织所掩盖。经B超证实有表面ODD的儿童,其自发荧光敏感度为94%[45]。然而,在不经B超确认的研究中(很可能有较多包埋性玻璃膜疣的儿童患者),自发荧光检测包埋性玻璃膜疣的范围为27%~56%[42,43]。
眼底荧光素血管造影(FA)
FA是一种实用但具有侵入性的检查,通常有助于鉴别真性和假性视乳头水肿。ODD的FA有几个共同特征,包括视盘染色、视乳头周围脉络膜毛细血管充盈延迟、视盘早期或晚期无渗漏以及ODD染色(图2)[46]。最近一项针对儿童患者的研究显示,在鉴别ODD和真性视乳头水肿的所有检查方法中,FA具有最高的准确性(97%)[42]。FA的局限性包括静脉注射,后者可能通过使用口服荧光素而避免[47]。
OCT
利用OCT诊断ODD并与真性视乳头水肿相鉴别的方法最近引起了人们极大的兴趣。使用OCT分析ODD包括:进行rNFL分析或使用增强深度成像(EDI)、扫频源OCT直接可视化。在OCT上,ODD表现为具有低反射核心和高反射边界的局灶性团块(图2)。OCT是否能够准确地区分ODD与真性视乳头水肿目前一直存在争议。最近,视盘玻璃膜疣研究联合会(Optic Disc Drusen Studies Consortium)提出了使用OCT诊断ODD的建议[48]。他们对扫描前和扫描采集过程提出了标准化建议,并为密集视神经扫描、放射状视神经扫描、视盘周扫描和黄斑扫描指定具体参数[48]。该建议的目的是为研究人员和临床医生建立可靠、一致的ODD诊断标准。尽管这个建议至关重要,但可能不适用于儿童患者,因为该标准化是基于成人患者,因此其中表面性玻璃膜疣较多,而包埋性玻璃膜疣的患者少于50%。他们的发现表明,在EDI-OCT上,ODD总是位于筛板上方,其核心信号差、经常有高反射边缘[48]。
专门针对儿童患者的研究显示,OCT是否有助于鉴别ODD和乳头状水肿存在争议。一项研究发现,EDI-OCT可检测到17/25例包埋性ODD[49]。而最近另一项对儿童患者的研究表明,EDI-OCT鉴别真性视乳头水肿和ODD的准确率为67%[42]。
比较各种诊断试验的研究
很少有研究对ODD的各种诊断试验进行比较[42,43]。最近,Chang等人发表了一项研究,比较了B超、自发荧光、FA和OCT在鉴别儿童假性和真性视乳头水肿的差异[42]。这项研究的结果(表2)显示,FA对二者的鉴别诊断准确率最高(97%),其次分别是B超(74%)、OCT(67%~71%)、眼底照相(66%)和自发荧光(62%)。
并发症和疾病管理
尽管ODD是一种良性病变,但在一些患者中也存在可能导致视野缺损的罕见并发症。如上所述,一些ODD儿童可能发生视野缺损,并随着年龄的增长而增加。ODD也可能与血管并发症有关,如出血[50-52]、脉络膜新生血管膜[53],血管阻塞甚至是缺血性视神经病变[54]。这些血管并发症虽然很罕见,但已有相关报道。
考虑到出现视野缺损和其他罕见并发症的风险,建议患有ODD的儿童每年至少接受一次眼科检查和视野检查。如检测到视野缺损,可考虑进行局部降眼压滴眼液治疗,然而目前尚未有研究来支持这一建议[28]。临床医生须谨记,由于存在呼吸抑制的风险,α受体激动剂在幼儿中禁用。
未来的发展方向
一些研究小组还发现,OCT上Bruch膜开口的改变有助于区分真性和假性视乳头水肿[18,55,56]。该研究领域目前较为活跃且充满前景:与假性视乳头水肿相比,真性视乳头水肿患者的Bruch膜开口水平直径增大。此外,未来的研究可能会将神经保护剂应用于那些有视视野缺损的ODD患者。
儿童视神经炎(ON)
流行病学
ON是一种临床诊断,定义为视神经的特发性脱髓鞘炎症状态,是由自身免疫或炎症性疾病(如结节病、系统性红斑狼疮)引起的非特发性病例,通常也被划入相同的诊断类别。儿童ON可单独发生或作为炎症性中枢神经系统疾病的一部分,如急性播散性脑脊髓炎(ADEM)、多发性硬化(MS)或视神经脊髓炎(NMO),ON约占儿童急性脱髓鞘事件的25%[57]。据估计,加拿大儿童ON的总发病率为0.2/100000[57]。在青春前期的儿童中,似乎没有性别差异;然而,在青春后期儿童中,女性患者占优势[58,59]。
临床表现和疾病管理
儿童ON的典型表现包括视力下降、色觉障碍和视野缺损。可能单眼受累,也可能双眼同时(2周内)或先后(2~12周)受累。年幼儿童(72%<10岁)比年长儿童(30%)更容易发生双眼受累[60]。30%~77%的患者主诉为动眼疼或头痛[61-64]。能够进行自动视野检查的患者中,最常见的视野缺损是中心暗点[61,65]。
一些儿童ON患者的视力(VA)可能相对正常,视力高于20/40的约占20%。而更多儿童的视力受到严重影响,视力低于20/200约占60%[64,66]。一项仅包括青春前期儿童的病例研究显示,该年龄段ON患者的视力受影响更严重,视力低于20/200约占90%[67]。常见的临床特征包括视盘水肿(40%~70%)[61,64,68]、RAPD或视神经苍白(反复发作或晚期阶段)。在儿童ON的长期预后通常较好,大多数(58%~97%)儿童的视力恢复高于20/40[58,64,66,69]。最近,一项随访时间至少一年以上的儿童研究发现,89%的患者在1年后视力恢复高于20/40[63]。rNFL结构因病因而不同,其中ADEM患者最差[70]。
儿童和成人ON患者之间有几个重要差异。就表现而言,成人患者比儿童患者更容易出现眼球运动疼痛(90% vs.53%)[68]。此外,大多数成人患者表现为单眼球后受累,而儿童患者通常表现为双眼视神经水肿(1/3 vs. 40%~70%)[61,66,71]。成人患者的VA通常比儿童患者好,视神经炎治疗试验显示,36%的成人患者VA低于20/200,而90%的青春前期患者VA低于20/200[67,72]。
虽然ON是一种临床诊断,但需要进行检查以排除引起儿童视盘水肿的其他原因(表3)。
Full table
传统的检查包括头颅和眼眶磁MRI、腰椎穿刺, CSF的蛋白质、葡萄糖、细胞、寡克隆区带、IgG指数分析以及培养。MRI检查在T1加权像上显示视神经增厚,T2加权像上显示高信号。值得注意的是,ON患者的腰椎穿刺开放压力有时会升高,因此可能导致双眼ON和IIH的鉴别困难[73,74]。临床表现可指导实验室检测,而后者通常包括检测结节病、结核病、梅毒、莱姆病、巴尔通体感染和系统性红斑狼疮等疾病的生物标志物。如果怀疑NMO,可以进行脊柱MRI和水通道蛋白-4(AQP4)检测。
与ON相关的神经性和炎性综合征
儿童ON可能是一种孤立疾病,也可能继发于感染、炎性疾病或是系统性脱髓鞘疾病的一部分。在年幼儿童中,ON有可能继发于病毒感染或疫苗接种,也可能与ADEM相关;而年长儿童通常以ON作为系统性脱髓鞘疾病(如MS或NMO)的初始表现。
相较于成人,孤立性ON在儿童中更常见,并且常与病毒感染、疫苗接种或非病毒感染(如莱姆病或支原体肺炎)有关[59,75]。AQP4抗体为阴性的儿童复发性ON可能与寡克隆区带阳性或抗MOG有关。孤立性ON不易复发,在加拿大儿童ON患者中仅占5%[57]。多次复发的ON,如与客观的视功能丧失相关,抗NMO阴性且对类固醇有反应、停药后复发,则可称为慢性复发性炎性视神经病变(CRION)。
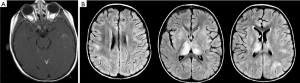
典型的ADEM是一种单相多灶性急性脱髓鞘疾病,主要出现在青春前期儿童,通常在病毒性疾病或疫苗接种之后发生[76]。ADEM的特征是脑病症状、发热和脑膜刺激征,由于在发病初期脑白质病变,因此MRI T2加权像和flair序列出现大片、均匀的高信号(图3)[77]。与MS相比,ADEM多为单相不易复发,且缺乏新的播散[76]。
儿童MS的诊断与成人相似,采用McDonald标准。然而,当12岁之前的儿童出现ON时,McDonald标准的阳性预测值较低[76]。儿童MS病例中约10%~20%以ON为表现特征[78]。ON初次发作后出现MS的风险高度依赖于发病年龄、MRI表现和CSF结果(OCB阳性)。约有13%~36%的ON患儿最终会被诊断为MS[62,66,71],出现MS的风险高度依赖于发病年龄以及最初脑MRI上是否存在白质病变[64,71]。据估计,年龄每增加1岁,患MS的风险就增加32%。此外,最近的一项荟萃分析显示,脑MRI上出现一处白质病变,最终诊断MS的优势比将增加到28.0[60]。在一项欧洲研究中,MS的风险比为1.08/1岁[79]。此外,MS的风险也取决于种族和区域[59]。
NMO的典型特征是视神经炎和横贯性脊髓炎,MRI表现为纵行广泛的视神经和横贯性脊髓病变。最近修订的NMOSD诊断标准国际共识按照AQP4抗体表达状态进行分类,还包括T2加权成像上存在高信号视神经病变(或T1加权钆增强病变),视神经病变延伸超过视神经长度的50%,横贯性脊髓炎病变跨越至少3个相邻的椎体节段[80]。共识小组指出,脊柱病变在儿童NMO中的诊断特异性较低,因为它们也可能发生在ADEM和儿童MS中。与NMO相关的儿童ON常常视力较差,从NMO开始出现到严重视力丧失(<20/200)的时间中位数估计只有1.3年[81]。
治疗
治疗儿童ON的方案因医师而异,通常取决于患者的年龄、系统性共病偏侧、MRI表现和视力丧失的严重程度。通常使用的糖皮质激素冲击治疗是从成人ON治疗试验推断而来:静脉注射甲基强的松龙,3~5天为一疗程(20~30 mg/kg/天,最多1克/天)[82]。长期(>2周)与短期(<2周)的口服激素减量是否影响疗效仍有争议[83]。由于没有前瞻性随机试验,目前尚不清楚激素治疗对长期预后的益处。对于严重激素耐药患者,可考虑静脉注射丙种球蛋白(IVIG)和血浆置换。如果诊断为MS或NMO,建议进行全身性疾病治疗。
未来的发展方向
目前出现一些儿童ON诊断和管理的新辅助检测,不过其有效性目前仍在研究中。例如,通过OCT测量rNFL和神经节细胞层可能对患者(有或没有MS)的长期随访有作用[84-86]。结构与功能相结合将有助于确定这些发现的本质。此外,抗髓鞘少突胶质细胞糖蛋白抗体(anti-MOG)是一种在年轻脑病患者中普遍存在的抗体,在MS、ADEM或NMO表现不典型的情况下可能是一种有用的辅助检测[87]。初步研究表明,与儿童其他脱髓鞘疾病相比,抗MOG阳性预后可能更好[88,89]。抗MOG抗体与ADEM以及儿童复发性ON之间的关系仍有待研究。
由于缺乏有关儿童ON的病史和治疗的前瞻性数据,因此对这些病例进行循证管理的能力受到了限制。最近,儿童眼病研究学组(PEDIG)和神经眼科疾病研究协会(NORDIC)联合启动了一项前瞻性数据收集研究,计划在2年内,从45个地区入组100名急性儿童ON患者。其目的是在儿童ON患者中开展前瞻性治疗研究,主要评估该研究入组患者的能力并在第6个月进行视力检查,其他检查还包括生活质量指标、OCT、低对比度视力、MRI和NMO抗体状态等。
儿童视路胶质瘤(OPG)
流行病学
OPG是由星形胶质细胞组成的低级别胶质肿瘤,它累及从视神经到视辐射的任何视觉通路。OPGs通常根据其在神经影像学上的特征性表现进行诊断(见下文),但也需经过病理学检查。OPG的组织学表现为良性,其中1型星形胶质细胞的分子遗传组成与CNS中其他低级别星形胶质细胞瘤相似[90-93]。最近有文献讨论了OPG是“良性错构瘤”还是“毛细胞星形细胞瘤”,大多数专家一致认为,由于OPG与其他CNS星形细胞瘤的分子组成和免疫组织化学特征相同,因此最准确的名称是毛细胞星形细胞瘤[93]。
OPGs在患有1型神经纤维瘤病(NF1)的儿童中发病率为15%~20%,而在一般人群中较为罕见,约占所有颅内肿瘤的1%,占儿童颅内肿瘤的3%~5%[93,94]。70%的OPG出现在10岁前(年龄中位数 6.5岁),也有较少年长患者似乎新发OPG[95-97]。
临床表现和疾病管理
OPGs的临床表现取决于发病年龄、病变部位、大脑半球优势。单眼前段视神经胶质瘤通常引起视力下降、色觉障碍和视野缺损;眼科检查可发现RAPD、眼球突出、斜视或视盘水肿。后段视神经胶质瘤常表现为隐匿的视神经萎缩,而其余临床表现较少。交叉性OPGs往往比前部肿瘤确诊晚,因为它的临床表现较少、起病缓慢,而且视力丧失往往从周边开始。交叉性OPGs视野通常表现为双眼不对称的颞侧偏盲,许多患者为交界性暗点,即一只眼中心视力丧失,另一只眼颞侧视野缺损。眼科检查可发现视神经萎缩,由于较少肿瘤可向前延伸累及一侧或两侧视神经,因此也可能表现为眼球突出;其他可能的检查结果包括知觉性斜视、不对称性眼球震颤和下丘脑功能障碍。视交叉胶质瘤的眼球震颤有时与点头痉挛(spasmus nutants,SN)的眼球震颤相似,具有不对称、水平震颤波形。
前段OPGs的诊断通常基于神经影像学特征,包括视神经梭形增粗和弯曲。在静脉注射造影剂后增强的T1加权成像上,OPG呈等或低信号,而在T2加权成像上则呈高信号。不同部位OPGs的成像特征都是一致的。在诊断OPGs时,如果不知道患者是否为NF1,那么寻找MRI的NF1表现是很重要的——可表现为局部区域的信号异常增强(以前称为“未知明亮物体”),被认为是神经发育不良或髓鞘发育不良伴局灶性水肿的结果[98]。此外,对NF1患者进行体格检查还可发现咖啡牛奶斑、神经纤维瘤、腋窝或腹股沟雀斑、Lisch结节、骨骼改变(例如长骨弯曲)。如有必要,还可进行遗传学就诊。
OPGs自然病程的典型特征是生长缓慢、对视力的影响小、恶性转化的可能性小[93]。令人意外的是,那些孤立且与NF1无关的OPGs似乎更具攻击性,这类患者视力更差。散发性OPGs患儿的视力下降率约为70%,而与NF1相关OPGs患儿的视力下降率较低,约为25%[99-105]。已知这些孤立OPGs与视交叉中存在的某些细胞有关,而影像学表现不明显[106]。因此影像学显示的孤立性视神经肿瘤“侵犯”视交叉的风险较低,在一项全国性临床试验中,35名患者中仅有7例发生[107]。在一项大型随机试验中,已假定但未得到证实的视力不良预后因素包括女性、发病年龄较早[108]和肿瘤位置较靠前[99,109-113]。视交叉胶质瘤通常比视神经肿瘤侵袭性小,但可能与垂体功能减退等全身并发症有关。在肿瘤生长方面,最靠后的病变(视束和放射)侵袭性似乎最小[99,111-113]。
OPGs的管理仍然存在争议,因为他们的自然病史不完全一致,并且有一些自我改善的病例[114]。然而,合理的治疗仍可以降低有风险的儿童视觉损害。已经证明,NF1患者的视力损害、内分泌疾病、社会交往障碍以及日常生活中的行动困难都与OPGs有关[115]。近年来,人们不再将肿瘤体积增长作为治疗指征,而是将视力损害(或生物标志物)作为治疗的主要指征[115]。尽管没有明确的共识,但大多数临床医生认为,治疗的最佳适应症是视功能明显损害(低于logMAR视力表0.2或视野缺损发展)[115]。其他不太常见但可能需要治疗的指征包括:一眼已经失明,而另一眼的视力异常;在无法评估视力的情况下怀疑视力损害;视力在功能阈值附近[100,115]。无视力改变的肿瘤增长并不提示需要治疗,然而,MRI上的肿瘤增长以及体格检查的改变可能需要密切监测或治疗的指标。
OPGs的一线治疗通常是化疗,因为放疗会给幼儿带来继发性恶性肿瘤、烟雾病和神经认知恶化的风险。常见的化疗药物包括长春新碱、长春花碱、卡铂、替莫唑胺和最近的贝伐单抗[116]。外科手术只适用于严重情况,如肿瘤畸形或侵犯重要的CNS结构。即使在进行性视力丧失的儿童中使用化疗,一些患者的病情仍会恶化,在一项研究中,28%的儿童在完成化疗后视力下降了至少2条logMAR线[110]。
监测和辅助测试
对于无OPG的NF1患者,目前建议:在8岁前每年进行一次全面的眼科检查,包括患者的视力、视野、瞳孔、眼球运动以及眼底;8岁后改为每两年进行一次检查,并一直持续到18岁[100]。在与OPG相关的NF1患者(NF1-OPG)中,在第一年里,每3个月需进行一次眼科和MRI检查;然后延长为每6个月一次,并持续到8岁;最后改为每年一次,直到18岁(如果没有疾病进展,5年后MRI在检测可减少频率)[115]。进行视力测试时,应尽可能使用适合年龄的视力表。考虑到儿童视力测试的易变性,研究人员试图寻找其他与视力损失相关的检查。最近受到关注的检查包括:视觉诱发电位[117-119]、OCT[120-124]、扩散张量成像[125,126]和容积MRI[127]。其中最有希望的两种检查方法是OCT检查前段OPG和弥散张量成像检查视束和视辐射病变。
OCT显示OPGs患儿的rNFL变薄,阈值约为80μm,低于此阈值患者更有可能出现视功能损害(VA或视野),该阈值可能用于无法配合VA测试的儿童。纵向研究也报道了OCT在诊断OPGs视力损失中的应用,rNFL厚度减少10%标志着视力损失,其灵敏度为70%。OCT在OPG患者管理中的整体作用仍在研究中。弥散张量成像是一种诊断脑白质损害程度的MRI技术。最近的一项研究表明,这种技术与视辐射OPGs患者的视力下降有关[115]。在一项小型研究中,弥散张量成像在预测一年后的视力变化也很有用[126]。
未来的发展方向
最近启动了一项多中心NF1-OPG研究,以探索OPGs的自然史。这项研究将有助于界定视力结果以及可能有助于未来治疗的生物标志。此外,一项随机治疗试验也于近期启动,以比较联合使用长春花碱和贝伐单抗与单独使用长春花碱的疗效。随后的治疗试验可能会效仿。我们在理解OPGs分子改变的基础上建立了新的靶向治疗方案,如丝裂原活化蛋白激酶(MEK)抑制剂。未来的试验将阐明MEK抑制剂以及雷帕霉素复合物(mTOR)抑制剂和法尼基转移酶抑制剂等哺乳动物靶点疗法是否对这些肿瘤有效[128]。
Acknowledgments
Research to Prevent Blindness, Unrestricted Grant: SL Pineles.
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Karl C. Golnik and Andrew G. Lee) for the series “Neuro-ophthalmology” published in Annals of Eye Science. The article has undergone external peer review.
Conflicts of Interest: The author has completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/aes.2018.03.01). The series “Neuro-ophthalmology” was commissioned by the editorial office without any funding or sponsorship. The author has no other conflicts of interest to declare.
Ethical Statement: The author is accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
*(译者注:IIH又称大脑假瘤,原文并未注明,为便于读者阅读,译者将在后文用IIH一律替代大脑假瘤)
References
- Bursztyn LL, Sharan S, Walsh L, et al. Has rising pediatric obesity increased the incidence of idiopathic intracranial hypertension in children? Can J Ophthalmol 2014;49:87-91. [Crossref] [PubMed]
- Durcan FJ, Corbett JJ, Wall M. The incidence of pseudotumor cerebri. Population studies in Iowa and Louisiana. Arch Neurol 1988;45:875-7. [Crossref] [PubMed]
- Gordon K. Pediatric pseudotumor cerebri: descriptive epidemiology. Can J Neurol Sci 1997;24:219-21. [Crossref] [PubMed]
- Cinciripini GS, Donahue S, Borchert MS. Idiopathic intracranial hypertension in prepubertal pediatric patients: characteristics, treatment, and outcome. Am J Ophthalmol 1999;127:178-82. [Crossref] [PubMed]
- Phillips PH, Repka MX, Lambert SR. Pseudotumor cerebri in children. J AAPOS 1998;2:33-8. [Crossref] [PubMed]
- Rangwala LM, Liu GT. Pediatric idiopathic intracranial hypertension. Surv Ophthalmol 2007;52:597-617. [Crossref] [PubMed]
- Balcer LJ, Liu GT, Forman S, et al. Idiopathic intracranial hypertension: relation of age and obesity in children. Neurology 1999;52:870-2. [Crossref] [PubMed]
- Sheldon CA, Paley GL, Xiao R, et al. Pediatric Idiopathic Intracranial Hypertension: Age, Gender, and Anthropometric Features at Diagnosis in a Large, Retrospective, Multisite Cohort. Ophthalmology 2016;123:2424-31. [Crossref] [PubMed]
- Salpietro V, Polizzi A, Berte LF, et al. Idiopathic intracranial hypertension: a unifying neuroendocrine hypothesis through the adrenal-brain axis. Neuro Endocrinol Lett 2012;33:569-73. [PubMed]
- Sinclair AJ, Onyimba CU, Khosla P, et al. Corticosteroids, 11beta-hydroxysteroid dehydrogenase isozymes and the rabbit choroid plexus. J Neuroendocrinol 2007;19:614-20. [Crossref] [PubMed]
- Margeta MA, Buckley EG, El-Dairi MA. Low cerebrospinal fluid protein in prepubertal children with idiopathic intracranial hypertension. J AAPOS 2015;19:135-9. [Crossref] [PubMed]
- Friedman DI, Liu GT, Digre KB. Revised diagnostic criteria for the pseudotumor cerebri syndrome in adults and children. Neurology 2013;81:1159-65. [Crossref] [PubMed]
- Hirfanoglu T, Aydin K, Serdaroglu A, et al. Novel Magnetic Resonance Imaging Findings in Children With Intracranial Hypertension. Pediatr Neurol 2015;53:151-6. [Crossref] [PubMed]
- Gorkem SB, Doganay S, Canpolat M, et al. MR imaging findings in children with pseudotumor cerebri and comparison with healthy controls. Childs Nerv Syst 2015;31:373-80. [Crossref] [PubMed]
- Dwyer CM, Prelog K, Owler BK. The role of venous sinus outflow obstruction in pediatric idiopathic intracranial hypertension. J Neurosurg Pediatr 2013;11:144-9. [Crossref] [PubMed]
- Shofty B, Ben-Sira L, Constantini S, et al. Optic nerve sheath diameter on MR imaging: establishment of norms and comparison of pediatric patients with idiopathic intracranial hypertension with healthy controls. AJNR Am J Neuroradiol 2012;33:366-9. [Crossref] [PubMed]
- Lim MJ, Pushparajah K, Jan W, et al. Magnetic resonance imaging changes in idiopathic intracranial hypertension in children. J Child Neurol 2010;25:294-9. [Crossref] [PubMed]
- Gospe SM 3rd, Bhatti MT, El-Dairi MA. Anatomic and visual function outcomes in paediatric idiopathic intracranial hypertension. Br J Ophthalmol 2016;100:505-9. [Crossref] [PubMed]
- El-Dairi MA, Holgado S, O'Donnell T, et al. Optical coherence tomography as a tool for monitoring pediatric pseudotumor cerebri. J AAPOS 2007;11:564-70. [Crossref] [PubMed]
- Chen JJ, Trobe JD. Optical Coherence Tomography Should Be Used Routinely to Monitor Patients With Idiopathic Intracranial Hypertension. J Neuroophthalmol 2016;36:453-9. [Crossref] [PubMed]
- OCT Sub-Study Committee for NORDIC Idiopathic Intracranial Hypertension Study Group. Baseline OCT measurements in the idiopathic intracranial hypertension treatment trial, part I: quality control, comparisons, and variability. Invest Ophthalmol Vis Sci 2014;55:8180-8. [Crossref] [PubMed]
- Optical Coherence Tomography Substudy Committee. Papilledema Outcomes from the Optical Coherence Tomography Substudy of the Idiopathic Intracranial Hypertension Treatment Trial. Ophthalmology 2015;122:1939-45.e2. [Crossref] [PubMed]
- Committee NIIHSGW, Wall M, McDermott MP, et al. Effect of acetazolamide on visual function in patients with idiopathic intracranial hypertension and mild visual loss: the idiopathic intracranial hypertension treatment trial. JAMA 2014;311:1641-51. [Crossref] [PubMed]
- Kovarik JJ, Doshi PN, Collinge JE, et al. Outcome of pediatric patients referred for papilledema. J AAPOS 2015;19:344-8. [Crossref] [PubMed]
- Auw-Haedrich C, Staubach F, Witschel H. Optic disk drusen. Surv Ophthalmol 2002;47:515-32. [Crossref] [PubMed]
- Erkkila H. Clinical appearance of optic disc drusen in childhood. Albrecht Von Graefes Arch Klin Exp Ophthalmol 1975;193:1-18. [Crossref] [PubMed]
- Erkkila H, Raitta C, Niemi KM. Ocular findings in four siblings with pseudoxanthoma elasticum. Acta Ophthalmol (Copenh) 1983;61:589-99. [Crossref] [PubMed]
- Chang MY, Pineles SL. Optic disk drusen in children. Surv Ophthalmol 2016;61:745-58. [Crossref] [PubMed]
- Mansour AM. Is there an association between optic disc drusen and angioid streaks? Graefes Arch Clin Exp Ophthalmol 1992;230:595-6. [Crossref] [PubMed]
- Pierro L, Brancato R, Minicucci M, et al. Echographic diagnosis of Drusen of the optic nerve head in patients with angioid streaks. Ophthalmologica 1994;208:239-42. [Crossref] [PubMed]
- Nischal KK, Hingorani M, Bentley CR, et al. Ocular ultrasound in Alagille syndrome: a new sign. Ophthalmology 1997;104:79-85. [Crossref] [PubMed]
- Spencer WH. Drusen of the optic disk and aberrant axoplasmic transport. The XXXIV Edward Jackson memorial lecture. Am J Ophthalmol 1978;85:1-12. [Crossref] [PubMed]
- Tso MO. Pathology and pathogenesis of cystoid macular edema. Ophthalmologica 1981;183:46-54. [Crossref] [PubMed]
- Mustonen E, Kallanranta T, Toivakka E. Neurological findings in patients with pseudopapilloedema with and without verified optic disc drusen. Acta Neurol Scand 1983;68:218-30. [Crossref] [PubMed]
- Sacks JG, O'Grady RB, Choromokos E, et al. The pathogenesis of optic nerve drusen. A hypothesis. Arch Ophthalmol 1977;95:425-8. [Crossref] [PubMed]
- Erkkila H. Optic disc drusen in children. Acta Ophthalmol Suppl 1977;3-44. [PubMed]
- Lorentzen SE. Drusen of the optic disk. A clinical and genetic study. Acta Ophthalmol (Copenh) 1966;1-180. [PubMed]
- Noval S, Visa J, Contreras I. Visual field defects due to optic disk drusen in children. Graefes Arch Clin Exp Ophthalmol 2013;251:2445-50. [Crossref] [PubMed]
- Sarkies NJ, Sanders MD. Optic disc drusen and episodic visual loss. Br J Ophthalmol 1987;71:537-9. [Crossref] [PubMed]
- Mustonen E. Pseudopapilloedema with and without verified optic disc drusen. A clinical analysis I. Acta Ophthalmol (Copenh) 1983;61:1037-56. [Crossref] [PubMed]
- Savino PJ, Glaser JS, Rosenberg MA. A clinical analysis of pseudopapilledema. II. Visual field defects. Arch Ophthalmol 1979;97:71-5. [Crossref] [PubMed]
- Chang MY, Velez FG, Demer JL, et al. Accuracy of Diagnostic Imaging Modalities for Classifying Pediatric Eyes as Papilledema Versus Pseudopapilledema. Ophthalmology 2017;124:1839-48. [Crossref] [PubMed]
- Kurz-Levin MM, Landau K. A comparison of imaging techniques for diagnosing drusen of the optic nerve head. Arch Ophthalmol 1999;117:1045-9. [Crossref] [PubMed]
- Noel LP, Clarke WN, MacInnis BJ. Detection of drusen of the optic disc in children by B-scan ultrasonography. Can J Ophthalmol 1983;18:266-8. [PubMed]
- Gili P, Flores-Rodriguez P, Yanguela J, et al. Using autofluorescence to detect optic nerve head drusen in children. J AAPOS 2013;17:568-71. [Crossref] [PubMed]
- Pineles SL, Arnold AC. Fluorescein angiographic identification of optic disc drusen with and without optic disc edema. J Neuroophthalmol 2012;32:17-22. [Crossref] [PubMed]
- Ghose S, Nayak BK. Role of oral fluorescein in the diagnosis of early papilloedema in children. Br J Ophthalmol 1987;71:910-5. [Crossref] [PubMed]
- Malmqvist L, Bursztyn L, Costello F, et al. The Optic Disc Drusen Studies Consortium Recommendations for Diagnosis of Optic Disc Drusen Using Optical Coherence Tomography. J Neuroophthalmol 2017; [Epub ahead of print]. [Crossref] [PubMed]
- Merchant KY, Su D, Park SC, et al. Enhanced depth imaging optical coherence tomography of optic nerve head drusen. Ophthalmology 2013;120:1409-14. [Crossref] [PubMed]
- Borruat FX, Sanders MD. Vascular anomalies and complications of optic nerve drusen. Klin Monbl Augenheilkd 1996;208:294-6. [Crossref] [PubMed]
- Lee KM, Hwang JM, Woo SJ. Hemorrhagic complications of optic nerve head drusen on spectral domain optical coherence tomography. Retina 2014;34:1142-8. [Crossref] [PubMed]
- Sanders TE, Gay AJ, Newman M. Drusen of the optic disk-hemorrhagic complications. Trans Am Ophthalmol Soc 1970;68:186-218. [PubMed]
- Mustonen E. Optic disc drusen and tumours of the chiasmal region. Acta Ophthalmol (Copenh) 1977;55:191-200. [Crossref] [PubMed]
- Nanji AA, Klein KS, Pelak VS, et al. Nonarteritic anterior ischemic optic neuropathy in a child with optic disk drusen. J AAPOS 2012;16:207-9. [Crossref] [PubMed]
- Lee YA, Tomsak RL, Sadikovic Z, et al. Use of Ocular Coherence Tomography in Children With Idiopathic Intracranial Hypertension-A Single-Center Experience. Pediatr Neurol 2016;58:101-6.e1. [Crossref] [PubMed]
- Thompson AC, Bhatti MT, El-Dairi MA. Bruch's membrane opening on optical coherence tomography in pediatric papilledema and pseudopapilledema. J AAPOS 2018;22:38-43.e3. [Crossref] [PubMed]
- Banwell B, Kennedy J, Sadovnick D, et al. Incidence of acquired demyelination of the CNS in Canadian children. Neurology 2009;72:232-9. [Crossref] [PubMed]
- Absoud M, Cummins C, Desai N, et al. Childhood optic neuritis clinical features and outcome. Arch Dis Child 2011;96:860-2. [Crossref] [PubMed]
- Chang MY, Pineles SL. Pediatric Optic Neuritis. Semin Pediatr Neurol 2017;24:122-8. [Crossref] [PubMed]
- Waldman AT, Stull LB, Galetta SL, et al. Pediatric optic neuritis and risk of multiple sclerosis: meta-analysis of observational studies. J AAPOS 2011;15:441-6. [Crossref] [PubMed]
- Lana-Peixoto MA, Andrade GC. The clinical profile of childhood optic neuritis. Arq Neuropsiquiatr 2001;59:311-7. [Crossref] [PubMed]
- Lucchinetti CF, Kiers L, O'Duffy A, et al. Risk factors for developing multiple sclerosis after childhood optic neuritis. Neurology 1997;49:1413-8. [Crossref] [PubMed]
- Wan MJ, Adebona O, Benson LA, et al. Visual outcomes in pediatric optic neuritis. Am J Ophthalmol 2014;158:503-7.e2. [Crossref] [PubMed]
- Wilejto M, Shroff M, Buncic JR, et al. The clinical features, MRI findings, and outcome of optic neuritis in children. Neurology 2006;67:258-62. [Crossref] [PubMed]
- Kennedy C, Carroll FD. Optic neuritis in children. Trans Am Acad Ophthalmol Otolaryngol 1960;64:700-12. [PubMed]
- Bonhomme GR, Waldman AT, Balcer LJ, et al. Pediatric optic neuritis: brain MRI abnormalities and risk of multiple sclerosis. Neurology 2009;72:881-5. [Crossref] [PubMed]
- Borchert M, Liu GT, Pineles S, et al. Pediatric Optic Neuritis: What Is New. J Neuroophthalmol 2017;37:S14-S22. [Crossref] [PubMed]
- Yeh EA, Graves JS, Benson LA, et al. Pediatric optic neuritis. Neurology 2016;87:S53-8. [Crossref] [PubMed]
- Malik MT, Healy BC, Benson LA, et al. Factors associated with recovery from acute optic neuritis in patients with multiple sclerosis. Neurology 2014;82:2173-9. [Crossref] [PubMed]
- Yeh EA, Weinstock-Guttman B, Lincoff N, et al. Retinal nerve fiber thickness in inflammatory demyelinating diseases of childhood onset. Mult Scler 2009;15:802-10. [Crossref] [PubMed]
- Morales DS, Siakowski RM, Howard CW, et al. Optic neuritis in children. J Ophthalmic Nurs Technol 2000;19:270-4; quiz 5-6. [PubMed]
- . Visual function 5 years after optic neuritis: experience of the Optic Neuritis Treatment Trial. The Optic Neuritis Study Group. Arch Ophthalmol 1997;115:1545-52. [Crossref] [PubMed]
- Avery RA, Shah SS, Licht DJ, et al. Reference range for cerebrospinal fluid opening pressure in children. N Engl J Med 2010;363:891-3. [Crossref] [PubMed]
- Narula S, Liu GT, Avery RA, et al. Elevated cerebrospinal fluid opening pressure in a pediatric demyelinating disease cohort. Pediatr Neurol 2015;52:446-9. [Crossref] [PubMed]
- Rappoport D, Goldenberg-Cohen N, Luckman J, et al. Parainfectious optic neuritis: manifestations in children vs adults. J Neuroophthalmol 2014;34:122-9. [Crossref] [PubMed]
- Brenton JN, Banwell BL. Therapeutic Approach to the Management of Pediatric Demyelinating Disease: Multiple Sclerosis and Acute Disseminated Encephalomyelitis. Neurotherapeutics 2016;13:84-95. [Crossref] [PubMed]
- Young NP, Weinshenker BG, Lucchinetti CF. Acute disseminated encephalomyelitis: current understanding and controversies. Semin Neurol 2008;28:84-94. [Crossref] [PubMed]
- Dale RC, Brilot F, Banwell B. Pediatric central nervous system inflammatory demyelination: acute disseminated encephalomyelitis, clinically isolated syndromes, neuromyelitis optica, and multiple sclerosis. Curr Opin Neurol 2009;22:233-40. [Crossref] [PubMed]
- Heussinger N, Kontopantelis E, Gburek-Augustat J, et al. Oligoclonal bands predict multiple sclerosis in children with optic neuritis. Ann Neurol 2015;77:1076-82. [Crossref] [PubMed]
- Wingerchuk DM, Banwell B, Bennett JL, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology 2015;85:177-89. [Crossref] [PubMed]
- Collongues N, Marignier R, Zephir H, et al. Long-term follow-up of neuromyelitis optica with a pediatric onset. Neurology 2010;75:1084-8. [Crossref] [PubMed]
- Waldman AT, Gorman MP, Rensel MR, et al. Management of pediatric central nervous system demyelinating disorders: consensus of United States neurologists. J Child Neurol 2011;26:675-82. [Crossref] [PubMed]
- Jayakody H, Bonthius DJ, Longmuir R, et al. Pediatric optic neuritis: does a prolonged course of steroids reduce relapses? A preliminary study. Pediatr Neurol 2014;51:721-5. [Crossref] [PubMed]
- Avery RA, Rajjoub RD, Trimboli-Heidler C, et al. Applications of optical coherence tomography in pediatric clinical neuroscience. Neuropediatrics 2015;46:88-97. [Crossref] [PubMed]
- Graves JS, Chohan H, Cedars B, et al. Sex differences and subclinical retinal injury in pediatric-onset MS. Mult Scler 2017;23:447-55. [Crossref] [PubMed]
- Yeh EA, Marrie RA, Reginald YA, et al. Functional-structural correlations in the afferent visual pathway in pediatric demyelination. Neurology 2014;83:2147-52. [Crossref] [PubMed]
- Ramanathan S, Dale RC, Brilot F. Anti-MOG antibody: The history, clinical phenotype, and pathogenicity of a serum biomarker for demyelination. Autoimmun Rev 2016;15:307-24. [Crossref] [PubMed]
- Hino-Fukuyo N, Haginoya K, Nakashima I, et al. Clinical features and long-term outcome of a group of Japanese children with inflammatory central nervous system disorders and seropositivity to myelin-oligodendrocyte glycoprotein antibodies. Brain Dev 2015;37:849-52. [Crossref] [PubMed]
- Thulasirajah S, Pohl D, Davila-Acosta J, et al. Myelin Oligodendrocyte Glycoprotein-Associated Pediatric Central Nervous System Demyelination: Clinical Course, Neuroimaging Findings, and Response to Therapy. Neuropediatrics 2016;47:245-52. [Crossref] [PubMed]
- Miller NR. Optic pathway gliomas are tumors! Ophthal Plast Reconstr Surg 2008;24:433. [Crossref] [PubMed]
- Liu GT, Katowitz JA, Rorke-Adams LB, et al. Optic pathway gliomas: neoplasms, not hamartomas. JAMA Ophthalmol 2013;131:646-50. [Crossref] [PubMed]
- Yeung SN, White VA, Nimmo M, et al. Optic nerve gliomas: role of Ki-67 staining of tumour and margins in predicting long-term outcome. Br J Ophthalmol 2011;95:1077-81. [Crossref] [PubMed]
- Miller NR. Optic Gliomas: Past, Present, and Future. J Neuroophthalmol 2016;36:460-73. [Crossref] [PubMed]
- Rasool N, Odel JG, Kazim M. Optic pathway glioma of childhood. Curr Opin Ophthalmol 2017;28:289-95. [Crossref] [PubMed]
- Dua S, Sharma K, Juneja R, et al. Unusual presentation of unilateral intra-orbital optic nerve pilocytic astrocytoma of the juvenile type in a geriatric patient. J Clin Neurosci 2016;25:143-4. [Crossref] [PubMed]
- Jamshidi S, Korengold M, Kobrine AI. Computed tomography of an optic chiasm glioma in an elderly patient. Surg Neurol 1984;21:83-7. [Crossref] [PubMed]
- Rush JA, Younge BR, Campbell RJ, et al. Optic glioma. Long-term follow-up of 85 histopathologically verified cases. Ophthalmology 1982;89:1213-9. [Crossref] [PubMed]
- DiMario FJ Jr, Ramsby G. Magnetic resonance imaging lesion analysis in neurofibromatosis type 1. Arch Neurol 1998;55:500-5. [Crossref] [PubMed]
- Balcer LJ, Liu GT, Heller G, et al. Visual loss in children with neurofibromatosis type 1 and optic pathway gliomas: relation to tumor location by magnetic resonance imaging. Am J Ophthalmol 2001;131:442-5. [Crossref] [PubMed]
- Listernick R, Ferner RE, Liu GT, et al. Optic pathway gliomas in neurofibromatosis-1: controversies and recommendations. Ann Neurol 2007;61:189-98. [Crossref] [PubMed]
- Listernick R, Charrow J, Greenwald M, et al. Natural history of optic pathway tumors in children with neurofibromatosis type 1: a longitudinal study. J Pediatr 1994;125:63-6. [Crossref] [PubMed]
- Thiagalingam S, Flaherty M, Billson F, et al. Neurofibromatosis type 1 and optic pathway gliomas: follow-up of 54 patients. Ophthalmology 2004;111:568-77. [Crossref] [PubMed]
- Singhal S, Birch JM, Kerr B, et al. Neurofibromatosis type 1 and sporadic optic gliomas. Arch Dis Child 2002;87:65-70. [Crossref] [PubMed]
- Czyzyk E, Jozwiak S, Roszkowski M, et al. Optic pathway gliomas in children with and without neurofibromatosis 1. J Child Neurol 2003;18:471-8. [Crossref] [PubMed]
- Wan MJ, Ullrich NJ, Manley PE, et al. Long-term visual outcomes of optic pathway gliomas in pediatric patients without neurofibromatosis type 1. J Neurooncol 2016;129:173-8. [Crossref] [PubMed]
- Spicer GJ, Kazim M, Glass LR, et al. Accuracy of MRI in defining tumor-free margin in optic nerve glioma surgery. Ophthal Plast Reconstr Surg 2013;29:277-80. [Crossref] [PubMed]
- . Tumor spread in unilateral optic glioma. Study report No. 2. North American Study Group for Optic Glioma. Neurofibromatosis 1989;2:195-203. [PubMed]
- Opocher E, Kremer LC, Da Dalt L, et al. Prognostic factors for progression of childhood optic pathway glioma: a systematic review. Eur J Cancer 2006;42:1807-16. [Crossref] [PubMed]
- Diggs-Andrews KA, Brown JA, Gianino SM, et al. Sex Is a major determinant of neuronal dysfunction in neurofibromatosis type 1. Ann Neurol 2014;75:309-16. [Crossref] [PubMed]
- Fisher MJ, Loguidice M, Gutmann DH, et al. Visual outcomes in children with neurofibromatosis type 1-associated optic pathway glioma following chemotherapy: a multicenter retrospective analysis. Neuro Oncol 2012;14:790-7. [Crossref] [PubMed]
- Tow SL, Chandela S, Miller NR, et al. Long-term outcome in children with gliomas of the anterior visual pathway. Pediatr Neurol 2003;28:262-70. [Crossref] [PubMed]
- Prada CE, Hufnagel RB, Hummel TR, et al. The Use of Magnetic Resonance Imaging Screening for Optic Pathway Gliomas in Children with Neurofibromatosis Type 1. J Pediatr 2015;167:851-6 e1.
- Dodgshun AJ, Elder JE, Hansford JR, et al. Long-term visual outcome after chemotherapy for optic pathway glioma in children: Site and age are strongly predictive. Cancer 2015;121:4190-6. [Crossref] [PubMed]
- Parsa CF, Hoyt CS, Lesser RL, et al. Spontaneous regression of optic gliomas: thirteen cases documented by serial neuroimaging. Arch Ophthalmol 2001;119:516-29. [Crossref] [PubMed]
- de Blank PMK, Fisher MJ, Liu GT, et al. Optic Pathway Gliomas in Neurofibromatosis Type 1: An Update: Surveillance, Treatment Indications, and Biomarkers of Vision. J Neuroophthalmol 2017;37:S23-S32. [Crossref] [PubMed]
- Avery RA, Hwang EI, Jakacki RI, et al. Marked recovery of vision in children with optic pathway gliomas treated with bevacizumab. JAMA Ophthalmol 2014;132:111-4. [Crossref] [PubMed]
- North K, Cochineas C, Tang E, et al. Optic gliomas in neurofibromatosis type 1: role of visual evoked potentials. Pediatr Neurol 1994;10:117-23. [Crossref] [PubMed]
- Jabbari B, Maitland CG, Morris LM, et al. The value of visual evoked potential as a screening test in neurofibromatosis. Arch Neurol 1985;42:1072-4. [Crossref] [PubMed]
- Lund AM, Skovby F. Optic gliomas in children with neurofibromatosis type 1. Eur J Pediatr 1991;150:835-8. [Crossref] [PubMed]
- Avery RA, Liu GT, Fisher MJ, et al. Retinal nerve fiber layer thickness in children with optic pathway gliomas. Am J Ophthalmol 2011;151:542-9.e2. [Crossref] [PubMed]
- Avery RA, Cnaan A, Schuman JS, et al. Longitudinal Change of Circumpapillary Retinal Nerve Fiber Layer Thickness in Children With Optic Pathway Gliomas. Am J Ophthalmol 2015;160:944-52.e1. [Crossref] [PubMed]
- Chang L, El-Dairi MA, Frempong TA, et al. Optical coherence tomography in the evaluation of neurofibromatosis type-1 subjects with optic pathway gliomas. J AAPOS 2010;14:511-7. [Crossref] [PubMed]
- Gu S, Glaug N, Cnaan A, et al. Ganglion cell layer-inner plexiform layer thickness and vision loss in young children with optic pathway gliomas. Invest Ophthalmol Vis Sci 2014;55:1402-8. [Crossref] [PubMed]
- Avery RA, Cnaan A, Schuman JS, et al. Reproducibility of circumpapillary retinal nerve fiber layer measurements using handheld optical coherence tomography in sedated children. Am J Ophthalmol 2014;158:780-7.e1. [Crossref] [PubMed]
- Lober RM, Guzman R, Cheshier SH, et al. Application of diffusion tensor tractography in pediatric optic pathway glioma. J Neurosurg Pediatr 2012;10:273-80. [Crossref] [PubMed]
- de Blank PM, Berman JI, Liu GT, et al. Fractional anisotropy of the optic radiations is associated with visual acuity loss in optic pathway gliomas of neurofibromatosis type 1. Neuro Oncol 2013;15:1088-95. [Crossref] [PubMed]
- Avery RA, Mansoor A, Idrees R, et al. Optic pathway glioma volume predicts retinal axon degeneration in neurofibromatosis type 1. Neurology 2016;87:2403-7. [Crossref] [PubMed]
- Bornhorst M, Frappaz D, Packer RJ. Pilocytic astrocytomas. Handb Clin Neurol 2016;134:329-44. [Crossref] [PubMed]

李鹏伟
黄河三门峡医院
眼科专业硕士,毕业于郑州大学。黄河三门峡医院眼科主治医师,有丰富的临床经验,擅长眼底病的诊治。曾在《国际眼科纵览》、《中国实用眼科杂志》等知名期刊发表多篇论文。知名医学公众号——“医学之声”特邀科普作家,撰写的系列小说《胡大夫的眼科门诊》受到业内同行的广泛好评。(更新时间:2021/7/28)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Pineles SL. Pediatric neuro-ophthalmology: not simply neuro-ophthalmology for small adults. Ann Eye Sci 2018;3:15.